فرایند الکترووینینگ برای بازیابی فلزات
فرایند الکترووینینگ
فرآیند الکترووینینگ یک روش نسبتاً سنتی برای بازیابی ضایعات فلزات از طریق سیستم شستشو و همزمان کاهش تولید پساب و تخلیه شیمیایی است. متداول ترین فلزات بازیابی شده با استفاده از الکترووینینگ به دلیل ارزش نسبی آنها طلا ، نقره ، مس ، کادمیوم و روی است.
الکترووینینگ یک فناوری الکترولیتی است که برای بازیابی فلزات از آبکاری استفاده می شود. اگرچه از الکترووینینگ به طور سنتی فقط برای بازیابی فلزات استفاده می شد. اما کاربرد آن در یک سیستم شستشو با طراحی و کنترل خوب می تواند مصرف آب شستشو ، تولید، تخلیه و تصفیه فاضلاب شیمیایی و حتی تصفیه پساب طلا سازی را به میزان قابل توجهی کاهش دهد.
یک واحد الکترووینینگ دارای سه جز اصلی است: (1) سلول الکترولیتی ، (2) یکسوساز و (3) پمپ. سلول الکترولیتی و یکسو کننده در شکل 1 نشان داده شده است. سلول الکترولیتی مخزنی است که در آن کاتدها و آندها به ترتیب به ترتیب متناوب مرتب می شوند (شکل 2 را ببینید). کاتدها و آندها به میله های باس مربوطه متصل می شوند ، که پتانسیل الکتریکی واحد را تأمین می کنند. سلول الکترولیتی ممکن است دارای ویژگی هایی برای بهبود گردش آب شستشو در سلول باشد ، مانند پخش کننده جریان یا اسپارگرهای هوا.

فرایند الکترووینینگ شکل 1: یکسو کننده الکترووینینگ و سلول الکترولیتی
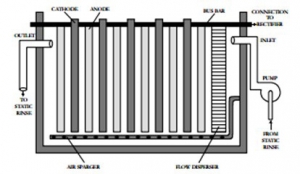
فرایند الکترووینینگ شکل 2: سطح مقطع واحد الکترووینینگ
هنگامی که یک واحد الکترووینینگ در حال کار است ، پتانسیل الکتریکی اعمال شده به الکترودها باعث مهاجرت فلزات محلول و سایر یون های دارای بار مثبت به سمت کاتدها و صفحه آنها می شود. با رسوب فلزات بر روی کاتدها ، تجمع فلزات میزان رسوب را کاهش می دهد. وقتی سرعت رسوب فلز کافی نیست ، کاتدها از سلول الکترولیتی برای بازیافت فلز در محل یا خارج از محل خارج می شوند.
در بعضی موارد ، فلزات بازیابی آنقدر خالص هستند که در حمام های فرآوری شده مجدداً مورد استفاده قرار می گیرند. از آنجا که فلزات در کاتدها به طور شیمیایی کاهش می یابند ، سایر اجزای آب شستشو در آندها اکسید می شوند. اگر سیانور وجود داشته باشد ، به سیانات و سپس به دی اکسید کربن و نیتروژن اکسید می شود.
الکترووینینگ معمولاً برای بازیابی طلا ، نقره ، مس ، کادمیوم و روی استفاده می شود. طلا و نقره به دلیل داشتن الکتروپتانسیل بالا ، موفق ترین بازیافت فلزات هستند. کروم تنها فلزی است که به طور معمول در آبکاری استفاده می شود و با جوشکاری مجدد قابل بازیافت نیست. بازیابی نیکل امکان پذیر است. اما این فرآیند بسیار حساس به pH است. زیرا pH باید در یک محدوده کوچک برای رسوب فلز حفظ شود. برخی از محلول های حاوی فلوروبورات ، مانند محلول های قلع و سرب قلع ، می توانند برخی از مواد آند را خورنده کنند. اکثر محلول های اچنت به سرعت رسوب فلزات را از کاتدها حل می کنند.
به منظور نشان دادن موارد ذکر شده در بالا ، ممکن است مفید باشد که مثالی از فرآیند الکتریکی سازی مس را دنبال کنید.
در طی فرآیند الکترووینینگ ، یون های مس که در محلول الکترولیت EW موجود است ، بر روی ورق های خالی فولاد ضد زنگ یا ورق های شروع کننده مس اندود می شوند. هنگامی که ورق های خالی فولاد ضد زنگ در مخازن پر از محلول الکترولیت غوطه ور می شوند. مس اساساً از طریق الکترولیز در جاهای خالی “رشد می کند”. جایی که جریان عرضی یک قطعه مس خالص ، یا کاتد جامد ، ضخامت 2-4 اینچ ایجاد می کند.
در الکترووینینگ ، با استفاده از جریان مستقیم برق مطابق با معادله (1) ، فلز از محلول به جای خالی کاتد رسوب می کند. در یک واکنش رقابتی ، یون های هیدروژن مطابق (2) به هیدروژن گازی تبدیل می شوند. از آنجا که غلظت یون های فلز در محلول کاهش می یابد ، پتانسیل (1) نزدیک شدن به (2) نزدیک می شود. و بیشتر جریان از طریق فرآیند تکامل هیدروژن مصرف می شود.
اکسیژن طبق معادله (3) همزمان از آندهای نامحلول تکامل می یابد.
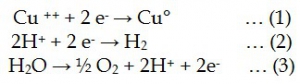
فرایند الکترووینینگ
در بیشتر موارد ، سلول های الکترووینینگ از یک طرح اولیه متشکل از کاتد ورق تخت متناوب و آند استفاده می کنند. همانطور که فلز بر روی کاتد آبکاری می شود ، فیلم مایع راکد مجاور سطح کاتد تمایل به تخلیه در چگالی جریان متا دارد. که این میزان رسوب فلز را تعیین می کند بیش از سرعت پخش یون های فلزی از طریق این فیلم به کاتد است.
اگر چگالی جریان خیلی زیاد باشد ، غلظت یون های فلزی در فیلم بیش از حد تخلیه می شود. و شرایطی را ایجاد می کند که به عنوان “قطبش غلظت” شناخته می شود. این امر منجر به تأثیر سو بر روی بازده فعلی و همچنین کیفیت رسوب ، در نتیجه تکامل هیدروژن می شود.
قسمت دوم
خلاصه:
فرآیند الکترووینینگ یک روش کلیدی برای بازیابی فلزات گرانبها است. و می تواند به معنای تجارت بزرگ خصوصاً هنگام پردازش اجزای روکش طلا باشد.
طلا در واقع از محلول های aurodicyanide تولید شده توسط شستشوی کربن لود شده بازیابی می شود. و این عامل هدایت واکنش های الکتروشیمیایی ناشی از آن است.
الکترووینینگ روش جالبی برای بازیابی طلا از محلول های نسبتاً غلیظ اورودیسیانید تولید شده توسط شستشوی کربن لود شده است. به شرطی که با استفاده از اسپری های فشارآب آب ، طلای آبکاری شده به راحتی از بین برود.
واکنش های الکتروشیمیایی زیر مربوط به روند الکترووینینگ طلا هستند.
(مقادیر E ذکر شده برای غلظت یون فلزات mol.dm-310-4 غلظت NaCN 0.2٪ و غلظت NaOH 2٪):

فرایند الکترووینینگ
با توجه به واکنش [1] در پتانسیل های منفی تر از پتانسیل برگشت پذیر ، طلا که به عنوان aurodicyanide (Au(CN)2-) در محلول وجود دارد ، به طلای فلزی تقلیل می یابد. واکنش [2] ، نشان دهنده کاهش اکسیژن در محلول های قلیایی ، واکنش کاتدی دیگری است که با رسوب طلا رقابت می کند. دلیل اصلی این امر این است که الکترولیت به دلیل تکامل اکسیژن در آند ، ممکن است از اکسیژن اشباع شود. واکنش [3] نشان دهنده تکامل هیدروژن است. که هنگام کار در مقادیر pH بالاتر از 10 ، با پتانسیل منفی تر از 96/0- VSHE با سرعت قابل توجهی اتفاق می افتد.
تکامل هیدروژن باید تحت کنترل جنبشی در محدوده قابل توجهی از پتانسیل های منفی تر از 96.0- VSHE باشد. بنابراین نسبت بالایی از جریان کاتدی را مصرف می کند. اصلی ترین واکنش آندی اکسیداسیون آب به اکسیژن است که توسط واکنش [2] نشان داده شده است.
واکنش کاهش سیانید فنجان (Cu(CN)32-) به مس فلزی در واکنش [4] نشان داده شده است. پتانسیل منفی بیشتر برای کاهش سیانور فنجان به مس فلزی نسبت به میزان کاهش اورودیسیانید به طلای فلزی ، نشانگر این است که طلا باید در این شرایط ترجیحاً نسبت به مس ورق بگیرد. با این حال ، در صورت استفاده از ظرفیت های اضافی بالا ، یا وقتی غلظت مس نسبت به طلا زیاد باشد ، مس ممکن است با طلا همدما شود.
از طرف دیگر ، فرآیند Ezinex در ایتالیا برای تولید الکتریکی روی از محلول های کلرید آمونیاک روی تجاری شده است. در این فرآیند ، روی در کاتد رسوب الکتریکی می یابد و آمونیاک در آند اکسید می شود. از کاتدهای تیتانیوم برای آبکاری روی و از الکترودهای گرافیت برای اکسیداسیون آندی آمونیاک استفاده می شود. رسوب الكتريكي نيكل از محلول هاي كلريد آمونيوم ممكن است راهكارهايي براي كاهش هيدروژن در سولفات اسيد يا الكترونيك كردن كلريد اسيد ارائه دهد. رسوب نیکل در کاتد را می توان با واکنش [5] بیان کرد:
فرایند الکترووینینگ
در R. Cruz-Gaona و همکاران مقاله یک مطالعه الکتروشیمیایی اساسی فرآیندهای کاتد در طول الکترووینینگ نیکل از محلولهای کلرید آمونیاک-آمونیوم ارائه شده است. چندین ترکیب محلول در این مطالعه استفاده شد.
ترکیب پایه به صورت زیر بود:
- نیکل (II) کلرید (NiCl2) M 0.2
- آمونیوم کلرید (NH4Cl) 4 M
- مقدار متغیر آمونیاک (NH3) اضافه شده به عنوان آمونیوم هیدروکسید (NH4OH)
یک تجزیه و تحلیل اثر بستر کاتد توسط ولتامتری چرخه ای انجام شد. این تجزیه و تحلیل نشان داد که هنگامی که از الکترود تیتانیوم استفاده شد ، خواص رسوب بهتری دارد. و رفتار الکتروشیمیایی نسبت به زمانی که از پلاتین و کربن شیشه ای استفاده می شود ، به دست می آید.
اثر کلرید آمونیوم بر رفتار الکتروشیمیایی نیکل از محیط کلرید بررسی شد (شکل 1). از این تجزیه و تحلیل مشاهده شد که جابجایی الکتریکی نیکل از محلول کلرید آمونیوم مزایای مهمی نسبت به فرایند جابجایی الکترود از محلول های ساده کلرید به نمایش می گذارد.
ویژگی مرتبط تر عدم تشکیل اکسید نیکل / هیدروکسید تشکیل شده در محیط کلرید (اوج A) بود.
این واقعیت عمدتا به دلیل تشکیل کمپلکس های نیکل و تثبیت پروتون ها توسط آمونیاک است. انتظار می رود این منجر به راندمان جریان بالا در الکترووینینگ نیکل از محلول های کلرید آمونیوم شود. اثر غلظت آمونیاک و دمای سیستم با استفاده از تکنیک های ولتامتری و تقویم سنجی تعیین شد. این مطالعه وقوع دو فرآیند را در طی فرایند کاهش الکتریکی نشان داد. این فرایندها به عنوان کاهش نیکل و تکامل هیدروژن در نظر گرفته شدند.
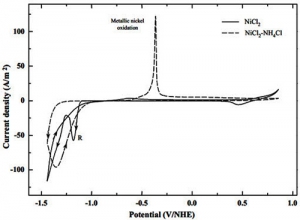
فرایند الکترووینینگ شکل 1: ولتامتری چرخه ای 0.2 میلی متر NiCl2 و 0.2 میلی متر NiCl2-4M NH4Cl با استفاده از الکترود تیتانیوم. ν = 20 میلی ولت بر ثانیه.
سرانجام مطالعه چگالی جریان و راندمان جریان در دماها و پتانسیل های مختلف به منظور تجزیه و تحلیل پدیده های درگیر در فرآیند الکترووینینگ نیکل انجام شد (شکل 2). از این داده ها مشاهده کردند که چگالی جریان بدست آمده با افزایش دما افزایش می یابد.
همچنین مشاهده شد که چگالی جریان بدست آمده برای هر دما به پتانسیل اعمال شده بستگی دارد. اما این روند خاصی را دنبال نمی کند (شکل 2). از این رو ، برای 30 و 50 درجه سانتیگراد حداقل تراکم جریان در -0.9 ولت بدست آمد. در حالی که برای در 70 درجه سانتیگراد حداکثر جریان در همین پتانسیل بدست آمد. این نتایج تأیید می کند که حداقل دو فرآیند در الکتریکی سازی نیکل دخیل هستند. و روند غالب بستگی به پتانسیل اعمال شده دارد.
داده های به دست آمده برای مطالعه C.E دو روش را که در الکترووینینگ نیکل دخیل است روشن تر می کند. در -0.9V C.E با افزایش دما کاهش می یابد و در -1.0V C.E با افزایش دما کاهش می یابد. بنابراین ، فرآیند مطلوب در -0.9 ولت ، که باعث کاهش بازده فعلی با افزایش دما می شود ، می تواند تکامل هیدروژن باشد. رسوب الكتريكي نيكل در دماي -1 / 0 ولت مورد علاقه قرار مي گيرد. و با افزايش دما افزايش مي يابد كه بازدهي جريان زيادي را به همراه دارد.
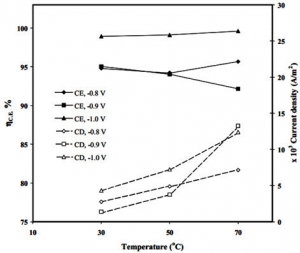
فرایند الکترووینینگ شکل 2: تأثیر دما و پتانسیل اعمال شده در بازده فعلی الکترووینینگ نیکل. محلول: 0.4 M Ni2 + و 0.8 M NH3 در کلرید آمونیوم.


دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.